01 反渗透前面为什么要加酸
对于水中含有的游离C02的去除,反渗透技术似乎无能为力,因为传统的反渗透技术中必须控制进水中LSI(即朗格利尔饱和指数)值,以防止反渗透膜结垢。
LSI值控制的一个重要参数是进水 PH 值:
如果 PH值为酸性,则不容易结垢。
如果PH为碱性,则结垢倾向十分明显。
所以传统的工艺中在反渗透系统前添加HCI溶液,能很好地防止CaCO3、MgCO3等沉淀物结垢;而很少在反渗透系统前添加 NaOH 溶液。
目前使用最广泛的是二氧化碳脱气塔,由于水中含有大量的碳酸氢盐碱度,经过H型离子交换器(即阳离子交换床)处理后,树脂上所带的H+被置换到水中而成为碳酸,所以脱CO2塔一般放在阳离子交换床的后面,阴离子交换床的前面。当水的PH 值小于4.3 时,水中碳酸几乎完全以二氧化碳的形式存在。
如下式的变化:H++HC03-=H2C03=C02+ H20
当 H+增加,即 PH越低时,上述反应就向右进行,此时,用一个装置水从上喷淋而下,空气从下鼓风而上,使空气流与水滴充分接触,由于空气中的二氧化碳量很小,分压很低,只占大气压力的 0.03%。根据亨利定律,经过H型离子交换器处理的水,由于二氧化碳分压高,逸入分压低的空气流中而被带走,从而除去了水中的二氧化碳也即除去了水中大量的阴离子 HCO3-,这样可以大大减轻阴床的负担,提高阴床的周期制水量,减少再生剂的消耗。
但是,二氧化碳脱气塔由于吸入的是生产环境中的空气,难免会带入空气中的杂质,通过与水源接触从而污染水源,引起阴床周期制水率的下降。
由于H+HCO:=HCO:=CO,+H,0这个化学反应是可逆的,当OH-增加时,该反应就向左进行,当水的 PH 值大于 8.2 时,水中的 CO,将全部转化为 HCO,这样 HCO.通过反渗透系统全部去除,间接实现了去除CO2的目的。
但是,在加碱的同时,反渗透膜的结垢趋势将十分明显,因为LSI值远远高于允许的范围。实践证明:当反渗透系统前加碱而不采取其他的措施时,RO浓水结品析出十分迅速,一般1~2个小时就可以在浓水侧发现白色的结晶。
其反应式为:Ca2++20H-+C02=CaC03+H20Mg2+ + 20H-+ CO2= MgCO3 + H20
针对以上问题,就需要根据来水水质来进行阻垢剂的来调配。
当了解到CO2、HCO3-和CO3=之间的平衡,就能够找到这一问题的最好答案,在密闭的体系内,CO2、HCO3-和CO3=的相对含量随pH值的变化而变化,低pH值条件下,CO2占主要部份,在中等pH值范围内,主要为HCO3-,高pH值范围内,主要为CO3。
由于RO膜可以脱除溶解性的离子而不能脱除溶解性的气体,RO产水中的CO2含量与RO进水中CO2的含量基本相同,但是HCO3-和CO3=常常能够减少1~2个数量级,这样就会打破进水中CO2、HCO3-和CO3=之间的平衡,在系列反应中,CO2将与H2O结合发生如下反应平衡的转移,直到建立新的平衡。
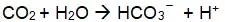 如果进水中含有CO2,则RO的产水pH值总会降低,对于大多数RO系统反渗透产水的pH值将有1~2个pH值的下降,当进水碱度和HCO3-高时,产水的pH值下降就更大。
如果进水中含有CO2,则RO的产水pH值总会降低,对于大多数RO系统反渗透产水的pH值将有1~2个pH值的下降,当进水碱度和HCO3-高时,产水的pH值下降就更大。
为数极少的进水,含较少的CO2、HCO3-或CO3=这样看到产水pH值的变化就少,某些国家和地区,对于饮用水pH值有规定,一般为6.5~9.0
PH值描述的是水溶液的酸碱性强弱程度。PH值范围在热力学标准状况时,当pH<7的时候,溶液呈酸性,当pH>7的时候,溶液呈碱性,当pH=7的时候,溶液为中性。
一般来说,反渗透设备产水的pH值在6.0~8.0之间。但是有些地方经过设备处理后的水PH值却偏低,这是为什么呢?
首先要从原水说起,反渗透设备的原水大多是自来水、地下水、地表水等,这些水的PH值一般在6-8范围内,经过反渗透膜的净化之后,反渗透设备可将大部分水中的钙镁离子、HCO3-去除掉而把CO2留下来,与反渗透设备进水相比,HCO3-浓度比例下降,因此PH值也相应的降低。一级反渗透产水的PH值通常在4.8-7的范围,实验表明反渗透二级进水PH在8.3左右,产水电导率最低。
如果设备的原水中含有CO2,则RO的产水pH值总会降低,对于大多数RO系统反渗透产水的pH值将有1~2个pH值的下降,当进水碱度和HCO3-高时,产水的pH值下降就更大。依照我国《生活饮用水标准》,自来水的pH值应控制在 6.5-8.5 范围内。所以只要在这个范围内的都是符合标准的。因此,反渗透设备产出后的水PH值会降低的。
如果反渗透设备产出的水ph值过低时,可以在水里加碱。一是提高pH值增加溶解度,二是与碳酸根或碳酸氢根离子进行反应,形成稳定的碳酸钠、碳酸氢钠和氢氧根的沉淀,然后被RO膜拦截脱掉。

