一、 腐蚀的机理 碳钢在水中的腐蚀是一个电化学过程。由于碳钢组织表面的不均一性( 材料中存在缺陷、杂质和溶质等),因此,当其侵入水中时,在其表面就会形成许多微小的腐蚀电池,其腐蚀机理及示意图(图一)如下: 图一 碳钢的电化学腐蚀 阳极反应: Fe
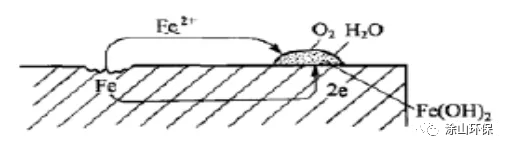
由上述腐蚀机理可知:造成碳钢腐蚀的是碳钢的阳极溶解反应,因此,碳钢的腐蚀破坏仅出现在腐蚀电池的阳极区,而腐蚀电池的阴极区是不腐蚀的。
且上述反应属于共轭反应,即阳极氧化反应和阴极还原反应必须同时进行,如其中一个反应被停止,则整个反应就会停止。
在冷却水中碳钢的腐蚀是电化学腐蚀,且电化学腐蚀又分为全面腐蚀和局部腐蚀。
全面腐蚀又称为均匀腐蚀,即在碳钢表面上大量分布着微阴极和微阳极,这种腐蚀不易造成穿孔,腐蚀产物氧化铁可在整个金属表面形成,在一定情况下有保护作用。全面腐蚀的阴、阳极并不分离,阴极面积等于阳极面积,阴极电位等于阳极电位。

当腐蚀集中在碳钢表面的某些部位时,称为局部腐蚀。局部腐蚀的速度很快,往往在早期就可使碳钢腐蚀穿孔或龟裂,所有危害性很大。循环冷却水处理中腐蚀控制的重点就是防止或减缓局部腐蚀的发生。局部腐蚀过程中阴、阳极互相分离,阴极面积大于阳极面积,但是阳极电位小于阴极电位,腐蚀产物无保护作用。
循环冷却水系统中常见的碳钢换热器局部腐蚀的形态见下述:
当两种不同的金属浸在导电性(循环冷却水)的水溶液中时,两种金属之间通常存在电位差(见图三 部分金属的电偶序)。如果这两种金属互相接触,则该电位差就会驱使电子在它们之间流动,从而形成一个腐蚀电池。与不接触时相比,耐蚀性较差的金属(即电位较低的金属)在接触后腐蚀速度通常会增加,而耐蚀性较好的金属(即电位较高的金属)在接触后腐蚀速度将下降。

以下以碳钢---黄铜材质的换热器(管束为黄铜、壳程为碳钢)的电偶腐蚀为例进行说明。碳钢---黄铜电偶腐蚀的示意图见图四,如下:

通过图四可知:发生电偶腐蚀后,阳极区的碳钢发生局部腐蚀现象,而阴极区的黄铜未出现腐蚀。

实例一:循环水监测换热器中夹牢碳钢试片用的螺帽及垫片下缝隙内碳钢表面发生的腐蚀,此种腐蚀也可称为
垫片腐蚀,具体见图六,如下:

实例二:循环冷却水系统中碳钢换热器内沉积物下的缝隙腐蚀,此种腐蚀也可称为
垢下腐蚀。产生垢下腐蚀的沉积物有:冷却水中的泥砂、腐蚀产物、水垢、微生物黏泥等。具体见图七(烯烃分离装置的160E701A),如下:

A、缝隙的存在:一条缝隙要成为腐蚀的部位,必须要宽到液位能流入,但又必须窄到能使进入缝隙的液体保持在静滞状态。即冷却水系统中因垫片、搭接缝或沉积物屏蔽,导致碳钢表面无法形成沉积型保护膜或补膜药剂无法有效进入缝隙、使前期形成的沉积型保护膜被破坏。因保护膜缺失或被破坏,导致缝隙腐蚀发生。
B、缝隙内外产生氧的浓差腐蚀电池:即缝隙内因冷却水静滞导致氧气无法有效进入,形成贫氧区---阳极;缝隙外碳钢表面冷却水中氧气充足,形成富氧区---阴极。腐蚀电池阴阳极发生以下反应:
C、有害阴离子(氯离子)的作用:即缝隙内因冷却水静滞导致
Fe2+过剩,过剩的正电荷需要带负电荷的氯离子迁移到缝隙中去,以保持电中性,于是缝隙内FeCl2的浓度增加。随后FeCl2水解,发生以下水解反应:
FeCl2+2H2O→Fe(OH)2↓+2H++2Cl-
盐酸是强电解质,其在水中会全部电离为H+和Cl-,而H+和Cl-的存在会进一步加速碳钢的腐蚀。

点蚀又称为孔蚀或坑蚀,是一种特殊形态的缝隙腐蚀或垢下腐蚀。其发生的机理与缝隙腐蚀的基本一致:
A、由于碳钢材料存在一定的缺陷、杂质等,当碳钢表面发生沉积,沉积物覆盖在碳钢表面,使水中的溶解氧和缓蚀剂不能扩散到碳钢表面,破坏其表面的钝化膜或沉积膜,碳钢中存在缺陷或杂质的部位先出现局部腐蚀现象。
C、温度对点蚀的影响也较大,对于形成钝化膜的系统,温度升高,钝化膜性能下降,点蚀倾向增加。
故点蚀经常发生在碳钢换热器的高温区和流速缓慢发生沉积的部位。蚀孔一般往重力方向生长。
点蚀是潜伏性和破坏性最大的一种腐蚀类型。点蚀都是大阴极小阳极,有自催化特性。小孔内腐蚀,使小孔周围受到保护。孔越小,阴、阳面积比越大,穿孔越快。
点蚀会使晶间腐蚀、应力腐蚀(晶间腐蚀、应力腐蚀一般常见于不锈钢换热器)和腐蚀疲劳等加剧,在很多情况下点蚀是这些类型腐蚀的起源。

磨损腐蚀又称为冲击腐蚀、冲刷腐蚀或磨蚀。磨损腐蚀是由于腐蚀性流体或碳钢表面间的相对运行引起的碳钢的加速破坏或腐蚀。磨损腐蚀的外表特征是:腐蚀的部位呈槽、沟、波纹和山谷形,还常常显示有方向性。
磨损腐蚀与碳钢表面的保护膜、冷却水流速及流态等因素有关。
一般冷却水流速超过一定数值,特别是在流速很高的情况下,一般会使磨损腐蚀加剧。主要原因:水流的冲击与耗氧腐蚀(氧含量增加,电化学腐蚀加剧)加剧。
在换热器中,当水不能充满整个换热器时,在水线附近特别容易发生水线腐蚀,这是因为在换热器中,水温升高,溶解氧逸到上部空间,在水线附件产生氧的浓差电池,导致并加速这种局部腐蚀。
微生物腐蚀一般不单独存在,往往与电化学腐蚀同时发生。引起腐蚀的微生物一般为细菌和真菌,但是也有藻类及原生动物(目前,我循环水系统危害性较大的细菌是铁细菌及硫酸还原菌)。微生物影响腐蚀主要是通过是使电极电位和浓差电池发生变化而间接或直接参与腐蚀作用。以下介绍循环水系统常见细菌的腐蚀机理:
产黏泥细菌大部分属于异养菌。它们在冷却水系统中产生一种胶状的、黏性的或黏泥状的、附着力很强的沉积物,这些沉积物覆盖在碳钢表面,阻止了冷却水中缓蚀剂、阻垢剂及杀菌剂的到达,使碳钢表面形成氧的浓差腐蚀电池而发生垢下腐蚀。
铁细菌是好气化能自养菌,直接引起碳钢的腐蚀,其在冷却水系统中在亚铁转化为高铁的过程中起催化作用,能将细胞内的亚铁氧化为高铁,从而获得能量及繁殖,反应如下:
2Fe2++1.5O2+XH2O→Fe2O3·XH2O
通过反应生产大量锈瘤(氧化铁沉淀及黏泥的混合物),锈瘤遮盖碳钢表面,形成氧的浓差腐蚀电池,并使冷却水中的缓蚀剂难以在碳钢表面作用而生成保护膜,铁细菌还从碳钢表面的阳极区除去亚铁离子(腐蚀产物),从而加速碳钢的腐蚀。
硫酸还原菌属于厌氧菌,能异养亦能自养,但是以异养为主。其在冷却水中能将硫酸盐还原为硫化氢,从而获得能量及繁殖,反应如下:
CaSO4+8H++8e→Ca(OH)2+H2S+2H2O+能量
冷却水系统中如果硫酸还原菌大量繁殖,会使系统发生严重的腐蚀,因为其还原生成的硫化氢腐蚀碳钢,形成黑色的硫化铁沉积物,这些沉积物又进一步引起垢下腐蚀。
B、在溶解氧浓度较高时,即溶解氧的浓度超标临界点值,碳钢表面形成氧化膜,抑制腐蚀。
结合目前循环水系统的运行情况,即系统pH值控制在8.3,水温30℃,此种情况下,冷却水中溶解氧的含量一般在8~9mg/l,低于临界点含量(16mg/l),此种情况下,溶解氧通常是加速腐蚀的主要因素。
二氧化碳溶于冷却水中,生成碳酸或碳酸氢盐,使水的pH值下降,水的酸性增加,将有助于氢的析出和碳钢表面保护膜的溶解破坏,从而加速碳钢腐蚀。
目前循环水系统的pH值控制在8.3左右,故系统中主要含CO32-和HCO3-,二氧化碳的含量极低或几乎没有。
硫化氢能够加速碳钢等金属的腐蚀,其主要来自工艺过程污染、大气污染等(如一循外网有硫化氢换热器,且时常受外界酸性气体的影响),或是由于硫酸盐还原菌还原水中的硫酸盐后生成的。
二氧化硫进入循环水系统会降低系统的pH值,从而增加碳钢的腐蚀,其主要来自工艺过程污染、大气污染等。(如一循外网有硫化氢换热器,且时常受外界酸性气体的影响)
自然界中,正常温度下,水中pH值对碳钢的腐蚀存在以下规律:
A、pH值在4~10时,碳钢腐蚀速率几乎不变,主要原因:碳钢在这样的水体中,其表面常常形成
Fe(OH)2覆盖膜,此时碳钢的腐蚀速度主要决定于氧的扩散速度而几乎与pH值无关。
说明:循环水系统日常运行过程中其pH值控制在7.9~8.6,在水稳药剂正常控制的情况下,系统的碳钢腐蚀速率及铁含量可控制在一个较优的水平。在系统清洗预膜过程中,pH值一般控制在6~7,最低时为4~5,此种情况下,系统中的铁含量波动较大,主要是:系统停工过程中,部分设备暴露在空气中,其表面产生浮锈,通过降低pH值及投加清洗剂,将设备表面的浮锈清除(导致系统铁含量增加),以便露出洁净的设备本体,确保预膜质量。
B、pH值大于10时,碳钢表面被钝化,腐蚀速度继续下降。
C、pH值小于4时,铁表面保护膜被溶解,碳钢腐蚀速度急剧增加,主要是水中H+浓度增加发生析氢反应,碳钢发生析氢腐蚀,具体反应如下:
碳钢在冷却水中被腐蚀的主要原因是发生电化学腐蚀(即耗氧腐蚀),而决定腐蚀速度的又与氧的扩散速度有关,氧的扩散速度与水流流速直接相关。淡水中水流流速对碳钢的腐蚀影响见图十,如下:

通过图十可说明间接循环冷却水系统中冷却水流速对碳钢腐蚀速度的影响(其变化趋势是一致的,只是正常情况下,循环水系统中投加水稳药剂,故其腐蚀速度相比偏低),根据上图对粗糙钢的腐蚀速度进行以下说明:
A、流速较低时,碳钢的腐蚀速度随水流流速的增加而增加,当流速0.25m/s时,碳钢的腐蚀速度最高,主要原因:水流流速的增加,使碳钢表面的溶解氧增加,其表面发生耗氧腐蚀。
B、当水流流速从0.25m/s开始增加至0.9m/s,此过程中碳钢的腐蚀速度开始下降,当水流流速为0.9m/s时,腐蚀速度最低,主要原因:水的流速增加,导致碳钢表面的氧含量进一步增加,足够的氧使碳钢表面部分或全部钝化,即碳钢表面形成氧化性的保护膜(以γ
-Fe2O3为主),故碳钢的腐蚀速度下降。
C、当水流流速从0.9m/s继续增加,则碳钢的腐蚀速度会再次增加,在流速增加量不大的情况下,腐蚀速度增长有限,但是当流速大幅增加(大于20m/s),则腐蚀速度会大幅上涨,此时腐蚀类型将转变为以机械破坏为主的冲击腐蚀。

在此温度控制区间内,碳钢的腐蚀速度随温度的升高而增加,主要原因:此温度下,溶解氧的扩散速度增加,导致碳钢表面的电化学腐蚀阴极反应加强,从而导致阳极反应加剧,碳钢溶解或腐蚀。
A、水中溶解盐类浓度越高,水的导电性越大,即水的电导率增大,此时容易发生电化学作用,增大腐蚀电流,使腐蚀增加。
B、 影响Fe(OH)2的胶体状沉淀物的稳定度,使保护膜质量变差,增大腐蚀。
1)、水中的Clˉ、SO42-等离子含量高时,会增加水的腐蚀性;
2)、水中PO43-、CrO42-、WO42-等离子能钝化钢铁或生成难溶沉淀物覆盖金属表面,起到抑制腐蚀的作用;
3)、Ca2+、Zn2+、Fe2+等离子能与阴极产物OH-生成难溶的沉淀沉积在金属表面,起到防腐蚀作用;
4)、Cu2+、Fe3+等具有氧化性的阳离子,由于能促进阴极去极化作用,因而能加速腐蚀。
次氯酸钠投加是为了控制循环水系统的菌藻滋生,其投加到系统后一方面进行杀菌剥离,另一方面也带入了一定含量的氯离子。氯离子会使碳钢换热器的缝隙腐蚀及点蚀危害进一步加剧。
次氯酸钠投加到系统后,其杀菌效果主要通过余氯值进行判断,但是余氯值并非越高越好,淡水中余氯高低对碳钢腐蚀速度的影响具体见图十二,如下:

由上图可知:当水中的余氯在0.4mg/l以下控制时,碳钢的腐蚀速度在0.02mm/a左右;当水中的余氯为0.5mg/l时,碳钢的腐蚀速度开始迅速上升;当余氯到0.6mg/l时,碳钢的腐蚀速度将超0.075mm/a。
悬浮固体主要包括:空气中的尘埃、水垢、腐蚀产物、微生物黏泥等,其或者从空气进入,或者有补水带入,或者是系统运行中生成的。
当循环水流速降低时,这些悬浮物容易在换热器表面生成疏松的沉积物,引起垢下腐蚀;当循环水流速过高时,这些悬浮物的颗粒容易对换热器造成冲击腐蚀。
A、由于细菌繁殖所形成的黏泥沉积在碳钢表面,破坏保护膜,形成垢下腐蚀。
B、由细菌代谢作用引起氧和其他化合物的消耗,形成氧的浓差电池。
微生物代谢的产物对碳钢换热器腐蚀速度的影响从以下方面体现:
影响pH值或酸度;影响氧化还原电位;使环境的化学状况发生变化;生产或消耗氧而影响氧的浓度。
缓蚀剂的缓蚀机理可从电化学腐蚀抑制和形成金属保护膜两个角度来看。从电化学腐蚀角度看,缓蚀剂抑制了阳极或阴极过程,在碳钢表面产生极化作用,使腐蚀电流减小,达到缓蚀作用。从成膜理论角度看,缓蚀剂在碳钢表面形成一层保护膜,阻止了冷却水中氧的扩散和金属的溶解。
目前,循环水系统使用的缓蚀剂主要是锌盐(阴极缓蚀剂)和聚磷酸盐(阴极缓蚀剂),保护膜的类型属于沉淀型,主要成分氢氧化锌、磷酸钙、γ-Fe2O3等物质。
提高循环水系统的pH值可以降低碳钢的腐蚀速率,这是因为pH值提高后,碳钢表面容易形成碳酸盐保护膜,且pH值控制较高时,溶解氧可使碳钢表面形成γ-Fe2O3的 钝化膜。
这种方法是在碳钢换热器的传热表面或封头上涂防腐涂料,形成一层连续的牢固附着的薄膜,使金属与冷却水隔绝,避免受到腐蚀。
目前循环水各系统中只有二循B外网甲醇合成装置的个别换热器涂刷了防腐涂层,如图十三所示:

采用牺牲阳极法或外加电流法阴极保护,二者是基于电化学腐蚀原理的一种防腐蚀手段,是防止碳钢在工业循环水中腐蚀的有效的方法。
牺牲阳极法:在水的比电阻低于0.5Ω·cm时,可用镁、铝或锌阳极,水冷器采用阴极保护通常是将阳极块(锌块或镁块)安装在封头部分。
外加电流法:是通过外部电源来改变周围环境的电位,使得需要保护的设备的电位一直处在低于周围环境的状态,从而成为整个环境中的阴极,这样需要保护的设备就不会因为失去电子而发生腐蚀。外加电流阴极保护系统由
辅助阳极、测试桩、直流电源、辅助材料、参比电极和导线组成。
外加电流法较牺牲阳极法而言,投入及维护费用高,实施难度较大。
包括正常工业及回用补水,以及相关装置排放的生产废水。
确保旁滤系统正常运行,发挥其降低浊度的功能,同时及时清理格栅,清除系统中大的悬浮杂物,从而降低系统黏泥污垢的产生量,降低系统垢下腐蚀的风险。
严格管控水稳药剂,包括质量和投加量;同时根据监测换热器试管、挂片的运行情况及时调整水稳药剂的投加量,为循环水整个大系统腐蚀控制提供依据。
A、定期拆检换热器:应利用大检修对所有换热器进行定期拆检,清理换热器中沉积的黏泥或腐蚀产物,防止出现垢下腐蚀情况。
B、严格换热器的运行参数控制:确保换热器的循环水流速、工艺侧运行温度满足控制指标要求,降低垢下腐蚀风险。
F、加强换热器的日常运行管控,包括循环水侧水质等。
根据大检修换热器的实际拆检情况,制定切实可行的清洗预膜方案,并在执行过程中确保清洗预膜效果,保证换热器表面保护膜的质量,降低换热器电化学腐蚀的风险。
知识点:循环水系统碳钢的腐蚀及控制

























