00
00
引 言
为评价氯消毒过程对细菌的灭活效率,常采用细菌对数灭活率(log)、细菌灭活率达99.9%时的CT值(消毒剂余量与接触时间的乘积)和最小抑菌浓度(MIC)等评价方法进行分析。一般在相同氯消毒条件下,细菌对数灭活率偏低,CT值与MIC值偏高,均表示氯消毒对细菌的灭活效率更差、细菌本身的耐氯性更强。如图1所示,当余氯浓度为0.5 mg/L时,耐氯菌的对数灭活率比非耐氯菌约低0.5 log;当细菌灭活率达到99.9%时,耐氯菌的CT值约为非耐氯菌的1.5倍;耐氯菌灭活50%时的最小抑菌浓度值(MIC50)约为非耐氯菌灭活50%时的3.4倍。以上3种评价方法均可发现在相同的氯消毒条件下,耐氯菌的灭活效率明显低于非耐氯菌,体现其对氯的耐受性。虽然已有细菌灭活效率的评价方法,但是仍缺乏公认的判定耐氯菌的测试标准和界定细菌耐氯与否的量化数值。如世界卫生组织(World Health Organization,WHO)提出在常规氯消毒剂量下,细菌99%灭活所需时间小于1min的细菌耐氯能力低,而大于1min的细菌具有中等(1~30 min)或者强(>30 min)的耐氯能力;也有研究认为耐氯菌是经过氯消毒后相对丰度增加 200%的菌属,即消毒后耐氯菌生物量占样本中总生物量的比例(相对丰度,%)比消毒前增加了2倍或以上。这也说明氯消毒不能完全控制市政供水中耐氯菌带来的水质风险,可能会引起介水疾病的爆发、色度和浊度升高等水质安全问题。因此,有必要进一步探讨市政供水中耐氯菌的风险问题及其控制方法。
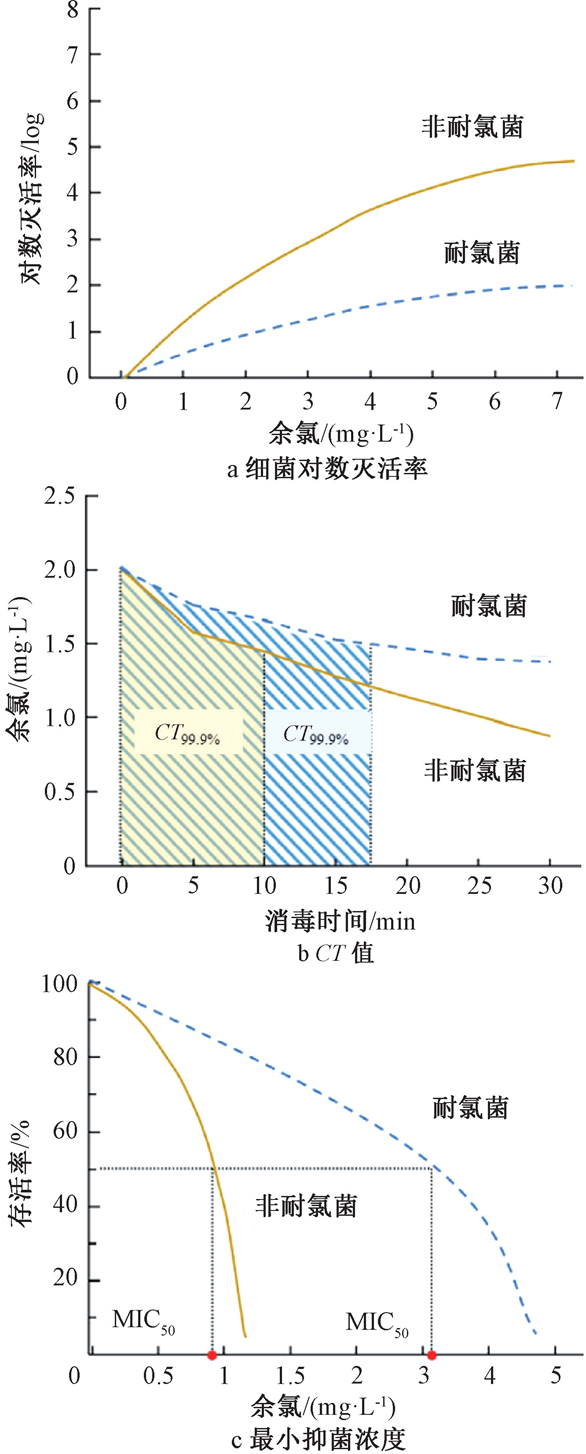
图1 细菌的灭活效率评价方法
01
供水系统中常见的耐氯菌与其潜在水质风险
1.1 供水系统中常见的耐氯菌
在供水系统中常见的耐氯菌属如表1所示,依据上述WHO提出的耐氯菌判定方法发现耐氯菌属18种,包括耐氯能力强的菌属2种,耐氯能力中等的菌属3种,耐氯能力低的菌属13种。其中耐氯能力强的分支杆菌属中龟分支杆菌在25℃的条件下实现99.9%灭活率的CT值为 120 mg·min/L;鸟分支杆菌在23℃的条件下实现99.9%灭活率的CT值为204 mg·min/L,约是大肠杆菌CT值的2 300倍。金分支杆菌和戈登分支杆菌实现99.9%灭活率的CT值分别比大肠杆菌高100和330倍。除此之外,依据消毒后菌属相对丰度增加 200%的耐氯菌判定方法,耐氯菌属还有14种。不同的耐氯菌属应对灭活威胁的主要耐消毒剂特性包括细胞基质的屏障作用、抗性基因的表达、降解酶或修复酶的产生等。其中细胞基质的屏障作用是最主要的耐氯机制,如分枝杆菌属和芽孢杆菌属均是由于细胞基质的屏障作用才产生较强的耐氯性。但单一耐氯菌细胞层面的耐氯机理及不同细菌之间耐氯特性量化参数的对比分析仍需进一步研究。同时,这也说明在各种耐消毒剂特性的保护下,供水过程中存活的耐氯菌可能会对饮用水安全造成潜在的威胁。
表1 供水系统中常见的耐氯菌属

1.2 耐氯菌的潜在水质风险
因耐氯菌在常规氯消毒剂的剂量下(0.5 mg/L)甚至在高剂量下(2.5 mg/L)具有耐受性,在水厂消毒处理后(30 min)更容易存活并且进入供水管网,导致饮用水安全存在风险。其风险包括:①部分耐氯菌本身就是致病菌或者条件致病菌,易产生健康威胁;②耐氯菌进入供水管网后继续增殖,会提高细菌抗生素耐药风险,以及引起龙头水细菌总数超标、色度和浊度升高等水质问题。
在供水系统中,致病菌属或免疫力低的人群易感染的条件致病菌大部分是耐氯菌。如表2所示,耐氯菌中致病菌/条件致病菌包括能够造成肺部感染的军团菌(Legionella),造成肺部和皮肤疾病、淋巴结炎的分枝杆菌(Mycobacteria),引起伤口感染和败血症的铜绿假单胞菌(Pseudomonas aeruginosa),引起呼吸道感染、败血症、皮肤感染等疾病的不动杆菌(Acinetobacter)等。当这些致病菌/条件致病菌进入管网到达水龙头时,可能会增加用户感染介水疾病的风险。研究表明,14%~19%的肠胃疾病主要是由供水管网中致病微生物所致。美国于2013-2014年期间爆发约 42件水污染事件,其中24起与军团菌等微生物的生长繁殖相关;2015年8月,军团菌引起的军团病在美国纽约市居民中爆发,导致86人患病,7人死亡。在我国,属于分枝杆菌的非结核分支杆菌感染率已由1990的4.3%上升至2010年的22.9%;在2005年至2017年间,全球27个国家发生149起铜绿假单胞菌医院感染暴发事件,其中35.9%与水系统相关。
氯消毒作用还可以通过影响抗生素耐药性基因(Antibiotics resistance gene, ARG)的表达,提高细菌的抗生素耐药性,这点在研究中已被发现和证实。如携带ARG的非耐氯细菌被灭活后释放出大量具有遗传信息的ARG载体,使部分耐氯菌获得ARG后转化为耐药细菌,这种转化带来了细菌多重耐药的后果,其产生的抗生素耐药性后对人类健康具有潜在风险。另外,耐氯菌附着在管壁形成的生物膜对氯消毒剂有更强的抵抗性,为致病菌提供了保护屏障;部分耐氯菌还会引起管壁腐蚀,导致“黄水”事件的发生,造成用户感官不适。
耐氯菌中包含的致病菌/条件致病菌有分枝杆菌属(Mycobacterium)、军团菌属(Legionella)、芽孢杆菌属(Bacillus)、链球菌属(Streptococcus)、弯曲杆菌属(Campylobacter)、肠球菌属(Enterococcus)、梭 菌 属 (Clostridium)、铜绿假单胞菌(Pseudomonas aeruginosa)、棒 状 杆 菌 属 (Corynebacterium)、沙门氏菌属(Salmonella)、金黄色葡萄球菌(Staphylococcus aureus)、不动杆菌(Acinetobacter)。
02
耐氯菌的耐氯机理
耐氯菌对于氯的灭活作用具有一定的抗性,其耐氯机理包括细胞基质的屏障作用、细胞的分子反应与微生物群体效应等几个方面。
2.1 细胞基质的屏障作用
研究发现对氯消毒剂耐受程度不同的细菌基质的组成存在明显差异。如图2所示,细胞膜、细胞壁、芽孢、胞外聚合物等基质可以提供屏障保护作用,阻碍氯消毒剂进入细菌细胞。

图2 耐氯菌耐氯机理
细胞膜的高疏水性。研究发现耐氯菌细胞膜中的饱和脂肪酸占比明显大于非耐氯菌,饱和脂肪酸占比越高,细胞疏水性越强,对水中氯消毒剂的抵抗力越强。如耐氯性较弱的金黄色葡萄球菌细胞膜中饱和脂肪酸的比例为19.2%,而耐氯性强的分支杆菌中该比例为95.7%。
芽孢表面的高疏水性与芽孢质的物理保护。芽孢表面的高疏水性(疏水率高于50% 时),可以减少氯消毒剂与芽孢表面接触的机会,进而降低氯消毒剂对细胞的破坏作用。如在消毒过程中ClO2投加量为 0.2 mg/L 时,芽孢杆菌的芽孢生成比例迅速增加66%~90%,芽孢表面疏水率高达87.31%±2.56%;另外芽孢主要成分如由肽聚糖、吡啶二羧酸和钙离子组成的皮层,由蛋白质和磷脂组成的芽孢质膜,由核糖体、DPA、钙离子及各种酶类组成的芽孢质等均可形成物理保护,阻碍消毒剂进入细胞。
胞外聚合物与消毒剂反应。细胞分泌的胞外聚合物包裹在细胞外层,其主要成分多糖和氨基酸也会与消毒分子发生反应,进一步降低氯消毒剂进入细胞的有效浓度。
因此,耐氯菌通过表面高疏水性和基质与氯消毒剂发生反应形成的细胞基质屏障作用阻碍了氯消毒剂扩散进入细胞,进而导致细菌耐氯。
2.2 细胞的分子反应
耐氯菌细胞的分子反应主要是对消毒剂有抗性的基因表达。
质粒(细胞染色体外能够自主复制的DNA分子)介导的消毒剂抗性。其中研究最多的是位于金黄色葡球菌质粒上消毒剂抗性决定因子qac基因家族,该基因家族中已发现的10余种基因可以表达多种化合物外排泵,通过改变细胞膜结构,导致消毒剂分子无法进入细胞,从而获得消毒剂抗性。细菌细胞还可以通过基因突变或者获得外部环境中的质粒而产生可遗传的耐氯性,即产生受环境影响的表观耐氯性。
降解酶或修复酶的产生。在消毒剂的胁迫作用下,对消毒剂有抗性的基因表达还会产生降解酶或修复酶,降低细胞对消毒剂的敏感性并逐渐适应有消毒剂的环境,从而产生了耐氯性。
因此,细菌可以通过抗性基因表达产生的外排泵作用和酶作用而产生耐氯。
2.3 微生物群体效应
在供水系统中,细菌会分泌胞外聚合物附着在介质表面(如管道内壁)形成生物膜,通过生物膜中多物种的微生物群体效应增强耐氯性。
(1)促进活性基因的转录。多物种的微生物群体可以提高负责氧化应激活性基因的转录,使细胞与细胞间的信号转导,改变胞外聚合物的组成和粘度,提高细菌的耐氯性。如铜绿假单胞菌中应激反应的主要调节因子RpoS在生物膜中表达强度是水中的3倍。
(2)促进修复酶和降解酶分泌。多物种生物膜中不同细菌之间还会以相互促进修复酶和降解酶分泌的合作方式应对消毒剂的氧化胁迫,产生协同耐氯作用,从而增强对氯消毒剂的耐受性。
因此,在生物膜中多细菌的群体效应可促进活性基因的转录以及酶分泌,为细菌提供抵御氯消毒剂灭活的能力。研究发现多物种混合形成的生物膜所需要的消毒剂浓度是正常值的1.6~40倍,而多物种生物膜中细菌的耐氯性是单一菌种生物膜细菌耐氯性的50~300 倍。
03
耐氯菌的风险控制
3.1 自来水厂的耐氯菌风险控制
在自来水厂的强化消毒技术中,常使用臭氧消毒(O3)、紫外线消毒(UV)、组合联用工艺消毒、膜过滤等方式去除细菌。不同耐氯菌灭活/去除方式的机理及控制效果如下文。
3.1.1 臭氧(O3)消毒
臭氧可以通过与细胞膜上的脂多糖和脂蛋白发生反应进而改变细胞膜通透性,影响细菌新陈代谢活动;臭氧还可以氧化分解细胞内部的酶以及破坏DNA等遗传物质使细菌死亡。臭氧消毒对耐氯菌具有一定的灭活能力,《室外给水设计标准》(GB 50013-2018)规定臭氧浓度宜为1.0~2.0 mg/L。但研究发现2.5 mg/L的臭氧反应 40 s可实现荧光假单胞菌5~6 log的灭活率;2 mg/L的臭氧反应45s可实现沙门氏菌5 log的灭活率;1.5 mg/L的臭氧反应60s对气单胞菌和假单胞菌的灭活率分别为3.76 log和3.69 log。在深圳某10万m3/d 水厂的深度处理过程中,臭氧投加量为0.5~1.0 mg/L时,对芽孢杆菌为代表的耐氯菌灭活率大于3 log。在以微污染江水为原水的70万m3/d某水厂中,经臭氧单元处理后,细菌被完全杀灭。因此适当的臭氧浓度可进一步提高耐氯菌的灭活率。但是在有溴离子存在的情况下,臭氧消毒会产生溴酸盐消毒副产物,会对饮用水造成潜在的风险,并且臭氧不具备持续杀菌能力,对管网中细菌的再生长没有控制效果。
3.1.2 紫外线(UV)消毒
紫外线(UV)消毒主要是通过细胞遗传物质(DNA 或 RNA)吸收紫外光后产生嘧啶二聚体,基因的转录和复制被抑制,从而实现灭菌。如图3所示,紫外波段可被分为四个区域:UV-A(315~400 nm)、UV-B(280~315 nm)、UV-C(200~280 nm)和真空紫外(Vacuum ultraviolet,VUV,100~200 nm)。其中波长越短,能量越强。常用的紫外光源属于UV-A、UV-B、UV-C区域,包括传统低压紫外(Low pressure mercury ultraviolet,LPUV,波长253.7 nm,汞蒸汽压1.3~13 Pa)、中压紫外(Medium pressure mercury ultraviolet,MPUV,波长200~400nm,蒸汽压约 102 kPa)和新兴紫外发光二极管(Ultraviolet light-emitting diode,UV-LEDs,波长210~365 nm)。其中 LPUV主要攻击破坏微生物细胞的DNA,MPUV可造成 DNA 和细胞膜脂质的同步氧化损伤。在耐氯菌灭活方面,紫外线消毒也具备灭活耐氯菌的能力。如较低的UV剂量(10~15 mJ/cm2)对铜绿假单胞菌、分枝杆菌等耐氯菌的灭活率均可达到 3~4 log。UV 剂量为 40 mJ/cm2 时,对烂泥假单胞菌和鞘氨醇单胞菌灭活率可达 4 log。UV 剂量为 100 mJ/cm2时,对枯草芽孢杆菌灭活率达到 3 log。在深圳市某50万 m3/d水厂中,碳砂过滤后水中细菌总数基本维持在 200~600 CFU/mL,加装紫外线消毒系统杀菌后出水细菌为未检出。在上海临江水厂中,单氯胺消毒的细菌灭活率只能达到97.71%~99.98%,增加紫外消毒后细菌基本全部灭活。UV消毒的缺点主要为汞灯的光电转化效率较低(15%~35%),耗费了大量的电能。并且UV 破坏的遗传物质在适当条件下可能被修复而重新恢复活性,包括“光复活”和“暗修复”,如在紫外线辐照度为 0.4mW/cm3照射灭活后的大肠杆菌在可见光下会发生明显的光复活,光复活率高达 84.5%。这也说明紫外线消毒没有持续杀菌能力,对管网中细菌的再生长无控制效果。

图3 紫外线光谱
3.1.3 组合联用工艺消毒
不同消毒剂对细菌的灭活机理与灭活能力有所差别,虽然氯消毒具有持续的消毒能力,但可能存在耐氯菌的风险;而臭氧消毒和紫外线消毒可以灭活耐氯菌,但消毒能力无法持续。因此在实际工程中,常常需要将消毒工艺组合联用。如图4所示,组合联用工艺消毒可进一步增强消毒能力,如采用 20 mg/L 的臭氧(灭活时间 2 min)和 6 mg/L的氯组合工艺对枯草芽孢杆菌芽孢的灭活率达到 7.1 log。当 UV 剂量为 67.8 mJ/cm2时与H2O2的投加量为 0.5 mmol/L组合时,对枯草芽孢杆菌的灭活效果可达5.88 log。通过UV/O3联用对枯草芽孢杆菌进行灭活时可将灭活效率提升约0.8 log。在实际水厂中,UV剂量为40 mJ/cm2联合出厂余氯浓度不低于0.6 mg/L的次氯酸钠投加量可以使耐氯菌的灭活率大于3.6 log。因此,通过与氯消毒联用的组合工艺不仅增强了细菌灭活效果,还保持了持续的消毒能力。但在组合联用工艺消毒时,紫外以及臭氧能够将水中的部分有机物氧化为含类甲基酮等结构的化合物,促进消毒副产物的形成;臭氧氧化过程中还可能生成致癌物溴酸盐 (BrO3-)。因此在使用组合工艺消毒时,应针对原水水质选取合适的消毒方式,进一步优化消毒剂的投加量,在灭活细菌的同时控制消毒副产物与溴酸盐的生成。

图4 不同控制方法下耐氯菌灭活效果对比
3.1.4 其他控制技术与方法
除以上通过细菌灭活实现耐氯菌控制的方法外,孔径(<0.1μm)小于细菌直径的超滤膜、纳滤膜、反渗透膜的物理截留作用也可有效去除细菌(包括耐氯菌)等微生物。超滤膜可有效去除铜绿假单胞菌和大肠菌群,对细菌总数的去除率为98.87%~99.71%;并且超滤膜的截留作用能够降低管网中75%的生物量。如北京石景山20万m3/d 水厂采用超滤膜系统细菌去除率大于6log;设计供水能力为30万 m3/d的南方某水厂将膜处理系统代替原设计的滤池,可实现大于99.99%的细菌灭活率;杭州30万 m3/d的清泰水厂经过预臭氧-炭砂过滤-膜组合工艺改造后细菌总数均未检出,实现了微生物的控制。因此通过水处理过程中增加膜过滤技术也可控制耐氯菌进入管网的机率。
随着技术的发展,一些耐氯菌的新型控制技术正在被研究。如纳米线辅助电穿孔结合氯消毒技术,即通过纳米电极增强局部电场,迫使细胞膜的磷脂双分子层形成空隙,有利于氯消毒剂进入细胞内部使其灭活。其对芽孢杆菌的灭活效果(>6 log)明显高于单独的电穿孔技术(1.11 log)和氯消毒技术(1.13 log)。另外,利用羟基自由基(OH·)氧化作用破坏细胞结构使细菌灭活的芬顿技术以及低温等离子体消毒技术也具有灭活耐氯菌的应用前景。
3.2 小区二次供水耐氯菌风险控制
二次供水设施被广泛用于高层建筑供水。管网中的耐氯菌进入二次供水设施后,由于水力停留时间的增加,耐氯菌会大量增殖进而造成水质恶化,因此有必要对二次供水中的耐氯菌进行有效控制。目前,二次供水水箱容积一般不得超过用户48 h的用水量。但有研究表明,二供水箱进水余氯在 0.5 mg/L时,水箱水龄需控制在50 h 以内,进水余氯在 0.3 mg/L 左右时,二供水箱水龄需控制在40 h以内。也有研究表明,生活饮用水在水箱中贮存 24 h后,余氯降为零;尤其在夏季水温较高时,余氯在12 h后即为零,细菌总数可达到 185 CFU/mL,超过相关水质标准要求的100 CFU/mL。因此,为保证供水安全,需要进一步控制二次供水水力停留时间并保持在12h以内,并且有必要在二次供水过程中再次进行补充消毒处理。
基于当前耐氯菌控制方法可知,紫外线消毒与臭氧消毒可以有效灭活耐氯菌。二次水箱在零余氯时细菌数约为1×103 CFU/mL,UV剂量为45~60 mJ/cm2时接触时间大于9 s即可保证去除二次供水过程中的细菌;臭氧消毒CT只需控制在 3~4 mg·min/L即可保证去除二次供水过程中的细菌。另外,二次供水水箱经过紫外线消毒和臭氧消毒后,余氯衰减系数分别减小0.084和0.052,说明经过消毒后,抑制了细菌增殖,减少了余氯的消耗。因此,为进一步控制市政供水的耐氯菌风险,可以通过二次供水端补充消毒结合调节水力停留时间的方式控制耐氯菌的增殖。
3.3 居民家庭耐氯菌风险控制方法
通过加热破坏细菌蛋白质结构的方式也可有效杀死细菌。依据世界卫生组织(WHO)的指导意见,60~66 ℃的温度可以杀死大多数细菌。例如,耐氯军团菌增殖温度范围是<50℃,当温度高于50℃时,90%以上的军团菌将会被灭活。食品在罐装过程中使用的水通常会被加热到巴氏杀菌的温度(68~70℃)。因此将龙头水100℃煮沸后可有效灭活耐氯菌,进而控制龙头水耐氯菌风险。在经过夜间用水低谷后,生活饮用水在管道内停留时间相对较长,耐氯菌将会大量增殖;特别是出现耐氯菌的致病风险时,可通过煮沸的方式进行灭菌。
综上所述,水厂端与氯消毒联用的组合工艺,结合二次供水端补充非氯的消毒方式或龙头水煮沸的方式均可有效灭活耐氯菌,完全可以控制耐氯菌带来的水质风险。
04
结论与展望
通过对耐氯菌的风险探讨发现,部分耐氯菌属于致病菌/条件致病菌,而且耐氯菌还可能转化为耐药细菌,这对人类的健康具有潜在风险。导致细菌耐氯的因素包括细胞基质的屏障作用、细胞的分子反应、微生物群体效应等。虽然氯消毒无法完全灭活细菌,但其他消毒技术(如紫外线消毒、臭氧消毒、组合联用工艺消毒等)可以灭活耐氯菌在3~4 log以上。并且通过二次供水补充消毒、水力停留时间的调节、龙头水煮沸等方式可有效控制耐氯菌带来的水质风险。因此,市政供水中耐氯菌的风险虽然存在,但经过末端处理后其影响是完全可控的。
当前虽然已有关于市政供水耐氯菌耐氯机理的研究,但仍缺乏单一耐氯菌细胞层面的耐氯机理及主要耐氯特性解析,缺乏不同细菌之间耐氯特性量化参数的对比分析,在判定耐氯菌的测试标准和界定值方面仍需进一步研究。
